Galvánelem áramkör működési elvét, a használata
Annak érdekében, hogy számba vegye a cellába, meg kell érteni az elvet tevékenységét, a szerkezeti jellemzői.
A fogyasztók ritkán figyelni az akkumulátort, és az akkumulátort, miközben ezek áramforrások a legnépszerűbb.

kémiai források
Mi a galvánelem? A rendszer alapját annak elektrolit. Az eszköz magában foglal egy kis tartályban, amely egy elektrolitot elválasztó anyagot adszorbeált. Továbbá, az áramkör a két galvanikus elem feltételezi katód és az anód. Mi a neve az ilyen galvánelem? Az áramkör összekötő a két fém feltételezi jelenlétében egy redox reakcióban.
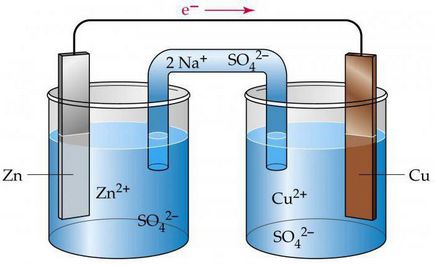
Az elemi elektrokémiai cella
Ez feltételez két lemez vagy rúd különböző fémekből, amelyek merítjük erős elektrolit oldatban. Működés közben az elektrokémiai cella, az anód oxidációs eljárást úgy hajtjuk végre társított elektron impakt.
A katód - a helyreállítás kíséretében elfogadása negatív részecskék. Van egy elektronok átvitelét egy külső körön keresztül, hogy az oxidálószer a redukálószer.
Példa elektrokémiai cella
Annak érdekében, hogy az elektronikus áramkörök elektrokémiai cellák, meg kell tudni, hogy az érték a standardpotenciál. Elemzése kiviteli alakban a réz-cink galván cella alapján működő felszabaduló energia a reakció során a réz és cink-szulfát.
Ez elektrokémiai cellában, az áramkört, amely lesz az alábbiakban megadott, a továbbiakban egy elem-Jacobi Daniel. Ez magában foglalja a vörösréz lemez, amely belemerül a réz-szulfát-oldatot (réz elektróda), és ez tartalmaz egy cink lemez, található a szulfát-oldatot (cink elektróda). Az oldatokat érintkeznek egymással, de annak érdekében, hogy elkerüljék a keverőelem használt partíció készült porózus anyagból.
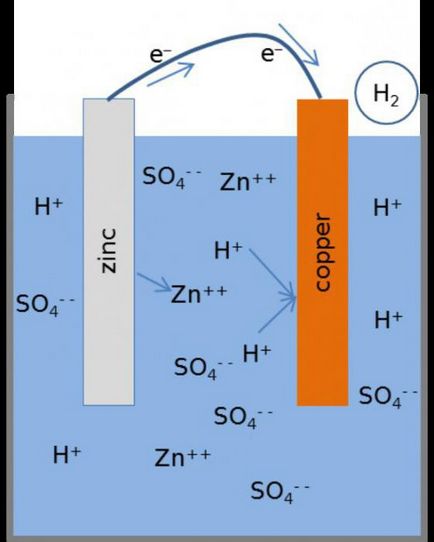
működési elve
Hogyan elektrokémiai cella, az áramkör formájában Zn ½ ZnSO4 ½½ CuSO4 ½ Cu? Működése során, amikor az elektromos áramkör zárva van, van egy cink-fém oxidációs folyamat.
Annak érintkezési felület sóoldattal megfigyelt konverziós atomok a kationok Zn2 +. A folyamatot kíséri a megjelenése „szabad” elektronok, ami mozog egy külső körön keresztül.
A végbemenő reakció a cink elektród, lehet az alábbi képlettel ábrázolható:
Recovery fém kationok végezzük réz elektróda. Negatív részecskék, hogy esik itt a cink-elektród, egyesítjük kationokkal réz, kicsapva őket formájában fém. A folyamat a következő:
Ha hozzá két reakció, a fent tárgyalt, kapjuk összességében leíró egyenletet működését cink-réz galvanikus elem.
A cink anódként viselkedik elektród, a katód réz. Modern elektrokémiai cellák és telepek magukban olyan egyik az elektrolit oldat, amely kiterjeszti az alkalmazási kör, így azok működése sokkal kényelmesebb és kényelmes.
Fajták elektrokémiai cella
A leggyakoribb tekinthető szén-cink sejtek. Ezek használata passzív szén áramkollektor érintkezésbe az anód, amely mint mangán-oxid (4). Ammónium-klorid elektrolit használnak egy paszta formában.
Ő nem fut, így nevezte galvánelem száraz. A jellemzője az a képesség, hogy „vissza” a művelet során, ami pozitívan befolyásolja a időtartama meghosszabbodik. Az ilyen elektrokémiai cellák olcsók, de alacsony teljesítmény. Alacsonyabb hőmérsékleteken ezek csökkentik annak hatékonyságát, és amikor azt fokozatosan növekszik elektrolit szárítás.
Alkáli elemek használatát is magukban foglalják egy lúgos oldat, így van egy csomó alkalmazás.
A lítium-sejtekben úgy működik, mint az anód aktív fém, ami pozitívan befolyásolja a hasznos élettartama. Lítium negatív elektród potenciál, ezért kis méretekkel hasonló elemek maximális névleges feszültség. Között hiányosságai ilyen rendszerekben lehetséges kiosztani a magas ár. Boncolás lítium áramforrások robbanásveszélyes.
következtetés
A működési elve bármilyen elektrokémiai cella alapját a redox folyamatokat előforduló a katód és az anód. Attól függően, hogy a fém kiválasztott elektrolit oldatot, a változó a sejt élete, és a nagysága a névleges feszültség. Jelenleg a kereslet a lítium, kadmium cellával kellően hosszú ideig az ő szolgáltatást.