Meghatározási módszerei elsőrendű reakció sebességi állandója, és
5. § kinetikája kémiai reakciók és katalízis.
Nem mindig termodinamikailag lehetséges reakciókat a valóságban. Ez annak a ténynek köszönhető, hogy a termodinamika nincs idő paraméter, így nem ad választ, amint ez a feltétel bekövetkezik. Meghatározása a feltételeket, amelyek mellett a reakció termodinamikailag lehetséges fog folyni megfelelő sebességgel az egyik fő probléma az a kémiai kinetika. A kinetikai az időtényező bevezetésre kerül, amely a termodinamika nem tekinthető.
A kémiai kinetika - a tanítás a törvényszerűségek a kémiai folyamat időben, vagy tanítás a mechanizmus és a kémiai reakciók sebességének.
A sor lépést alkotó kémiai reakció mechanizmus vagy rendszer az úgynevezett kémiai reakció.
A kémiai reakció sebességét.
Az sebessége kémiai reakció megérteni változások a mólszáma reagensek egységnyi idő per egységnyi térfogatra.
Átlagos sebesség - változást a reagáló anyagok koncentrációja egy adott idő alatt:
hozzáállás # 916; c / # 916; t lehet pozitív vagy negatív. Sebesség lehet mérni, ha megfigyeljük a csökkentés a koncentrációja a kiindulási vegyületet, akkor az arány beállított, mielőtt a mínusz jel, mivel a sebesség mindig pozitív mennyiséget. Ha a sebesség kifejezett koncentrációja a befogadó anyag, a plusz jel:
Ez annak tulajdonítható, hogy a koncentráció változását infinitezimális időintervallum (T2 -T1 → 0), meghatározzuk a valódi reakciósebesség pillanatában, mint a származék koncentrációjának időbeli (u = ± dc / dt).
Függése a reakciósebesség a koncentrációt.
Az alapvető posztulátum kémiai kinetika a tömeghatás törvénye, meg Guldberg és Vahe. Tekintsük a kémiai reakció:
A leíró egyenletet a függőség a kémiai reakció a koncentrációja a komponenseket a reakcióelegy sebessége, a kinetikus egyenlet nevezzük kémiai reakció.
A kinetikai egyenlete ez a reakció:
ahol k - arányossági tényező (állandó sebesség).
A tömeghatás törvénye: vegyi reakciók arányát minden egyes időpontban egyenesen arányos a termék a reagáló anyagok koncentrációit egy adott időpillanatban fokokban, amely megfelel a sztöchiometrikus együtthatók a reakció (a legegyszerűbb esetben).
A legtöbb esetben, nem számítva sebessége és mértéke állandó. Amikor CA = CB = 1 mol / l, u = k.
A fizikai értelmében a sebesség állandók a reakció sebességi állandója a kémiai reakció sebessége számszerűen egyenlő annak a feltételnek, hogy a reaktánsok koncentrációja állandó, és egyenlő a egységét. A sebességi állandó nem függ a koncentráció függ a hőmérséklettől és a természet az oldószer és a katalizátor jelenlétében.
Minden reakciók kinetikai kétoldalú vagy kinetikai visszafordítható. Kémiai reakció megfordítható, ha a reakció termékek reagálhatnak egymással, alkotó kiindulási anyagokat. A gyakorlatban, a holtjáték lehet olyan lassú, mint a közvetlen, hogy minden ésszerű pontossága visszafordíthatósága A reakció lehet elhanyagolni, és tekinthető egy irreverzibilis reakció, vagy egyoldalú. Szigorúan véve, mind reverzibilis kémiai reakció:
Abban az időben a kémiai egyensúly u1 = u2, azaz
ahol K - kémiai egyensúlyi állandó egyenlő az arány a sebességi állandója a határidős reakció sebességi állandója a fordított reakció.
Osztályozása reakciók molekuláris és sorrendben.
Abban a vizsgálatban, a kinetikáját a kémiai reakciók különböznek molekuláris és sorrendben.
Molekularitás reakciót száma határozza meg, hogy egyidejűleg részt vevő molekulák a szakaszban, amely határozza meg a sebességet minden a reakció (a leglassabb). Szerint ezt a funkciót a reakció szétválasztjuk egy mono-, bi- és trimolekuláris. Reakciók a nagyobb molekulatömegű gyakorlatilag ismeretlen, mivel a valószínűsége megfelel a négy molekula elhanyagolható.
Az, hogy a reakció lefutását az összege a kitevőket a koncentráció szempontjából a tömeghatás törvénye. Megkülönböztetni a teljes (megosztott) és magán reakció érdekében (minden reagens). A összege a kitevőket, amelyben a koncentrációja az összes kiindulási anyag tartalmazza a kinetikus egyenlet, meghatározza a teljes sorrendben. Különbséget reakció nulladik, első, második, harmadik és frakcionált megrendeléseket.
Egybeesés molekularitás a megbízás során csak a legegyszerűbb esetekben, amikor a reakció egy lépésben:
általános érdekében - 3, molekuláris - 3.
5.3.1. Egyenlet elsőrendű reakció.
Tekintsük a kémiai reakció: A → B.
Szét a változók: -ds / s = k dt, integrálni
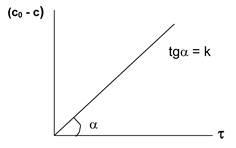
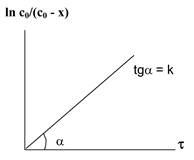
ha # 964; = 0 (a kezdeti időben a reakció), majd a c0 = ln const. azaz
ln c0 - ln c = kt vagy ln C0 / s = kt,
Legyen x - az átalakítás a kiindulási anyag: X = C0 - c.
dimenziója - [idő -1].
Elsőrendű sebességi állandóját reakció független a koncentrációtól. Lehet helyettesíteni, a kapott egyenlet koncentráció (mol / l) lehet mól. Ahelyett, hogy „C0” és a „(c0 - x)” helyettesítheti bármely értékek arányos a koncentrációval (vezetőképesség, sűrűség, viszkozitás, stb).
Jellemzésére a sebesség az elsőrendű reakció állandó mellett gyakran használják olyan mennyiségben úgynevezett felezési idejét.
A felezési idő (t1 / 2) - egy olyan időintervallumot, amely alatt reagál a fele vett mennyiségek:
A felezési idő nem függ a kezdeti koncentrációk, és függ sebességi állandó, azaz a ez jellemző az elsőrendű reakciók.
Az elsőrendű reakciók reakciók a radioaktív szétesés, izomerizáció, hidrolízis reakciók leginkább. Amikor nagy feleslegben az egyik reagenst a másikhoz képest, annak koncentrációja látszólag állandó marad a reakció során. Ebben az esetben, a sorrendben a reakció lesz az egyik kisebb, mint várható lenne a sztöchiometriai egyenletekkel.
Bimolekuláris reakciókban, ahol a sorrendben a reakció miatt feleslegben a reagensek egyike csökken egy egységet nevezett pseudomolecular.
Példa hidrolitikus bomlási reakciót homogén híg, vizes cukoroldat (cukorinverziót):
caharoza glükóz fruktóz
u = k [szacharóz] „[H2 O],
de a víz feleslegben van, és feltételezhető, hogy a [H2O] = const. majd
u = k * [szacharóz], ahol k * = k '[H2 O].
Ez egy példa pszeudo-elsőrendű reakció.
Egyenlet kétoldalas másodrendű reakció.
1. kiválasztásának módszere egyenletek.
A módszer abban áll, hogy ebben az esetben a kísérleti adatok az egyes anyagok koncentrációja megfelel az egyes azonnali elejétől a reakció a kinetikai egyenletek különböző rendű (ez a módszer nem csinál semmit, ha a sorrendben a reakció nagyobb, mint 3 vagy frakcionált)
Az, hogy a reakció megfelel a kinetikus egyenlet, amely különböző kezdeti koncentrációk a kiindulási anyagok és különböző időpontokban egy adott hőmérsékleten lesz állandó sebességgel állandó.
2. Grafikus integrál módszereket.
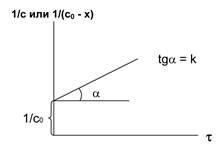
Nulladrendű: elsőrendű másodrendű
Ábra. 5.1. A változás a koncentráció időbeli a reakciókhoz
Keresse a koncentráció függvényében, azzal, hogy e grafikonon, attól függően, hogy az idő, hogy egy egyenes vonal (ábra. 5.1.).
3. féiperiódustói.
Felére-időszak függően a kezdeti koncentráció:
elsőrendű: t1 / 2 = 0693 / K;
Végzett kísérletek két különböző kiindulási koncentrációban (c0) „és (C0)„:
Válaszfalak (1) a (2):
4. A differenciális módszerrel, (a van't Hoff-módszer).
Felhasználási koncentráció függését a reakció sebessége a feltétellel egyenlőség a koncentrációk az összes kiindulási anyag (5.2 ábra ..): U = kc n. Logaritmus megadott kifejezés: LGU = LGK + nlgs.
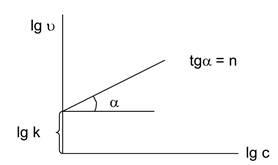
Ábra. 5.2. Függése a reakciósebesség a koncentrációt.
5. Integrált eljárás van't Hoff (attól függően, hogy a reakció sebessége a kezdeti koncentráció az első pillanatokban az idő - 10-15 s).
Mivel az első idő x ≈ 0.
A kísérleteket különböző kezdeti koncentrációk.
ahol a C1 és C2 venni a középső része, a vizsgálati válasz megfelelő # 916; t.
6. Módszer az izolálását Ostwald.
Koncentrációjának növelésére a „B” és „C” több, mint 10-szer. Az eljárás ezen anyagok nulla, azok koncentrációja nem fog változni. Határozza meg a „N1” egyike azoknak a módszereket, amelyeket a fent tárgyalt. Ahogy haladunk, sorrendjének meghatározásáról reakció anyagok B és C, azaz a N2 és N3.