Kovalens kémiai kötések - van
meghatározás
Kovalens kötés az úgynevezett kémiai kötés alakul ki, mivel a szocializációs atomjaik a vegyérték elektronok. A feltétele, a kovalens kötés átfedés atomi (AO), amelyek úgy vannak elrendezve vegyérték elektronok. A legegyszerűbb esetben, két átfedő AB képződéséhez vezet két molekulapálya (MO) összekötő MO és antibonding (antibonding) MO. Elektront osztott elhelyezve alacsonyabb kötési energia MO:
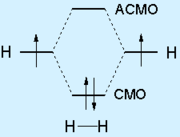
kötődés
Kovalens kötés (atomi kötés, kovalens kötés) - két atom közötti kötést miatt szocializációs (elektron megosztás) két elektron - mindegyik atom:
Emiatt, kovalens kötés irányított. Egy pár elektronok kommunikációs tartozik egyszerre mind a kötési atomok, például:
Típusú kovalens kötés
Háromféle kovalens kémiai kötés eltérő mechanizmusa kialakulása:
1. egyszeres kovalens kötés. A képződéséért minden atom biztosít egy párosítatlan elektront. A formáció a kovalens kötés hivatalos díjak az atomok változatlan marad. Ha a alkotó atomok azonos egyszeres kovalens kötés, akkor a valódi díjak az atomok a molekulában szintén azonosak, mert atomokkal együtt egy kötés egyaránt jártas szocializált elektronpár, egy ilyen kapcsolat az úgynevezett nem-poláros kovalens kötés. Ha az atomok különböző, akkor az arány a tulajdonosi szocializálódott elektronpárt határozza meg a különbség a electronegativities atomok, az atom a nagyobb elektronegativitási nagyobb mértékben van egy pár az elektronok, és így egy igazi töltés negatív, az atom egy kisebb elektronegativitási megszerzi rendre azonos nagyságú töltés, de pozitív előjellel.
2. A donor-akceptor kötés. A formáció ilyen kovalens kötés, mind az elektronok az egyik atom (donor), a második az atomok részt kötés kialakulását nevezzük akceptor. A kapott molekula a formai töltése a donoratom növeljük, és a formai töltése az akceptor atom csökkentjük.
3. A szemipoláris kötés. Ez a fajta egy kovalens kötés között van kialakítva egy atommal, amely osztatlan elektronpárt (nitrogén. Phosphorus. Kén. Halogének és m. P.), és az atom két párosítatlan elektront (oxigén. Kén). szemipoláros kötés kialakulása végbemegy két lépésben:
1. Oxidációs (átadása egy elektron) atom NEP atom két párosítatlan elektront. Ennek eredményeként, az atom NEP alakítunk a gyökkation (pozitívan töltött részecske egy párosítatlan elektront), és az atom két páratlan elektronnal - radikális anion (negatívan töltött részecske egy páratlan elektron).
2. szocializációja párosítatlan elektront (például abban az esetben egy egyszerű kovalens kötés).
A formáció egy atom a a szemipoláros kötés NEP növeli annak formai töltése egységenként, és az atom két párosítatlan elektront csökkenti azok formai töltése egységenként. Flash klipek kémiai kötés mechanizmusok itt lehet megtekinteni
Sigma (σ) -, pi (π) -bond - közelítő leírását a típusú kovalens kötések szerves molekulák, σ-kötést az jellemzi, hogy az elektron felhő sűrűsége legfeljebb a tengely mentén csatlakoznak az atommagba. A formáció a π -bond végzett úgynevezett oldalirányú átfedés elektron felhők, és a sűrűsége az elektron felhő maximális „fölött” és „alatta” a sík σ-kötést. Vegyük például az etilén. acetilén és a benzol.
Az etilén C2 H4 molekula kettős kötést CH2 = CH2. elektronikus képlet: H: C :: C: H. Cores etilén atomok egy síkban vannak. Három elektron felhők minden egyes szénatom képező három kovalens kötések egyéb atomok azonos síkban (a szög között körülbelül 120 °). Cloud negyedik szénatom egy vegyérték-elektron található alatt és felett a molekula síkja. Az ilyen elektron felhők mind szénatomok részben átfedik felett és alatt a molekula síkja, egy második kötést képez a szénatomok között. Először is, egy erősebb kovalens kötés között a szénatomok között az úgynevezett σ-kötés; második, kevésbé erős kovalens kötés az úgynevezett π-kötés.
A lineáris molekula acetilén
Ez σ-kötések közötti szénatomot és hidrogénatomot, egy σ-kötést két szénatom között és két π -bond között a szénatomok között. Két π -bond felett található a körét a σ-kötések két egymásra merőleges síkban.
Mind a hat szénatomot tartalmazó benzol gyűrűs molekula C6 H6 egy síkban fekszik. A szénatomok között a gyűrű síkjában vannak σ-kötés; azonos kommunikációs vannak minden egyes szénatom hidrogénatomokkal. A végrehajtás Ezen kapcsolatok szénatomok tölteni három elektron. Felhők negyedik vegyérték elektronok a szénatomok, amelynek alakja nyolcas található síkjára merőlegesen a benzol molekula. Minden ilyen felhő átfedésben van az elektron felhők az azonos szomszédos szénatomok. A benzolos molekula nem képződnek három különálló π -bond és egyetlen π az elektron rendszere a hat elektronok közös az összes szénatom. Bond között a szénatomok között, a benzol molekula teljesen azonos.
A kovalens kötés által alkotott megosztását elektronok (alkotnak egy közös elektron párok), amelyek során előforduló az átfedés elektron felhők. A kovalens kötés járó elektron felhők a két atom. Két fő típusa kovalens kötés:
- A kovalens kötés alakul ki a nem poláros nemfémes atomok az azonos kémiai elem. Ezeket az adatokat egyszerű anyagok. pl O2; N2; C12.
- Polar kovalens kötés között van kialakítva atomok különféle, nem-fémek.
Abban az esetben, például sósavval. a teljes elektronsűrűség eltolódik az oldalon a klór, miáltal klóratom történik részlegesen negatív töltéssel. hidrogénatom - egy részleges pozitív.
Példák anyagok kovalens kötés
Egy egyszerű kovalens kötés kapcsolódik atomok molekulák egyszerű gázok (H2. Cl2 és mtsai.) És vegyületek (H2 O, NH3. CH4. CO2. HCI és mtsai.). Vegyületek egy donor-akceptor kötés - ammónium-kation NH 4 +. tetrafluor-borát anion BF4 - és más vegyületek a szemipoláros kötés -. dinitrogén-oxid N2 O, O - -PCl3 +.
Kristályok kovalens szigetelők vagy félvezetők. Tipikus példák az atomi kristályok (atomok, amelyek egymással össze vannak kapcsolva kovalens (Atomic) kötvények) szolgálhat, mint a gyémánt. germánium és szilícium.
Nézze meg, mi a „kovalens kémiai kötés” más szótárak:
Chemical Communications - atomok közötti kötés a molekulában vagy a mol. vegyületet eredő átviteli vagy e-mail, az egyik atom egy másik, egy új e szocializációs pár (vagy csoport) tartalmaznak. Az erők vezető X. együtt. Coulomb, de X. együtt. leírható ... Fizikai enciklopédia
Chemical Communications - kölcsönhatás alkilcsoport, amelyben az elektronok tartozó két különböző atom (csoportok) gyakori (szocializált) a két atom (csoport), ami ezek összekapcsolása az molekulák és kristályokat. Két alaptípusa X. sz. ion ... ... A legtöbb Polytechnique enciklopédia
Chemical Communications - Chemical Communications, az a mechanizmus, amely atomokat összekapcsolódva egy olyan molekula. Van többféle egy ilyen kapcsolat, vagy alapján a vonzereje az ellentétes töltésű, vagy a kialakulását stabil konfigurációk megosztásával elektronokat. ... ... Tudományos és műszaki enciklopédia
Tapadás - kötés, a kölcsönhatás az atomok, ami a vegyület molekulái és a kristályok. Működési kémiai kötőerők elsősorban elektromos természetű. kémiai kötés kialakulása kíséri szerkezetátalakításának ... ... Illustrated Encyclopedic szótár
Kémiai kötés - kölcsönös vonzás atomok, képződéséhez vezető molekulák és a kristályok. Azt mondjuk, hogy egy olyan molekula vagy kristályos léteznek a szomszédos atomok H. o. Valence az atom (milyen részletesen ismertetjük) mutatja a kapcsolatok száma ... A Nagy Szovjet Enciklopédia
kémiai kötés - [kémiai kötés (kötés)] kölcsönös vonzás atomok, képződéséhez vezető molekulák és a kristályok. A vegyértéke atom számát jelzi kialakult kötések szomszédos adatok atommal. A „kémiai szerkezete” vezették be Akadémikus A. M. Butlerov in ... ... Encyclopedic szótár kohászati
Az ionos kémiai kötés - ionos kötést erős kémiai kötés képződik atomok közötti nagy elektronegativitása különbség, amelynél a teljes elektronpár teljesen át az atom nagyobb elektronegativitása. Egy példa egy olyan vegyület, CsF ... Wikipedia
Chemical Communications - Tapadás kölcsönhatás-atomot tartalmaznak, a jelenség által okozott átfedése elektron felhők kötő részecskék kíséri csökkentése teljes rendszer energia. A „kémiai szerkezet” volt először A. M. Butlerov 1861 ... ... Wikipedia
Kommunikációs (kémia) - Tapadás kölcsönhatás-atomot tartalmaznak, a jelenség által okozott átfedése elektron felhők kötő részecskék kíséri csökkentése teljes rendszer energia. A „kémiai szerkezet” volt először A. M. Butlerov 1861 ... ... Wikipedia