Kémiai kötés 2

Ábra. 2.1. A formáció-molekulákat a atomok kíséretében újraelosztása az elektronok a vegyérték pályák, és vezet a energia nyereség, mivel az energia a molekulák kisebb, mint az energia a noninteracting atomok. Az ábrán egy rendszer a nem-poláros kovalens kémiai kötés a hidrogénatomok.
Normális körülmények között, a molekuláris állapotban stabil, mint az atomi (2.1 ábra) .Obrazovanie molekulák atomok kíséretében újraelosztása az elektronok a vegyérték pályák, és vezet a energia nyereség, mivel az energia a molekulák kisebb, mint az energia a noninteracting atomok (3. melléklet). A gazdaság erői atomok a molekulák, kapott generalizált nazvaniehimicheskoy kapcsolatot.
Kémiai atomok közötti kötés végezzük, és a vegyérték elektronok elektromos természetű. Itt négy alaptípusa a kémiai kötések: kovalens, ionos, fém ivodorodnuyu.
1 kovalens kötés
Kémiai kötéssel, által végzett elektronpár nevezik atomi vagy kovalentnoy.Soedineniya a kovalens kötések nevezzük atomi vagy kovalens.
Abban az esetben, ha kovalens kötés előfordul kíséri energia felszabadulása átfedő elektron felhők a kölcsönható atomok (2.1 ábra). Így a pozitív töltésű atommag egy felhő nagy negatív töltés. Mivel a fellépés a Coulomb erők közötti vonzás ellentétes töltések növeli a negatív töltés sűrűség kedvez a konvergencia magok.
A kovalens kötés jön létre az párosítatlan elektronok a külső héját az atomok. Az elektronok ellentétes pörgetés obrazuyutelektronnuyu pár (Fig.2.2) közösek a kölcsönható atom. Ha volt atomok közötti kovalens kötés (a közös elektronpárt), ez az úgynevezett egyszeri, kétszeri, stb dve-
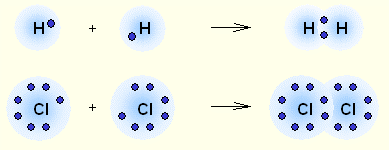

Ábra. 2.2. Kovalens kötés - a leggyakoribb formája a kémiai kötésre, amely miatt előfordul szocializációs elektronpár cseréje révén mechanizmus (a). amikor az egyes kölcsönható atomok szállít egy elektron keresztül vagy egy donor-akceptor mechanizmus (b). elektronpár, amikor továbbítják a közös használatát egy atom (donor) egy másik atom (akceptor).
A kovalens kötés van svoystvaminasyschaemosti inapravlennosti. Under telíthetőségével kovalens kötés azon képességére utal, az atomok a szomszédokkal alkotnak korlátozott számú csatlakozások száma határozza meg az összes-párosítatlan vegyérték elektronok. Rendező kovalens kötés azt a tényt tükrözi, hogy az erőket, amelyek az atomok egymás mellé, mentén vannak összekötő vonal a magok. Továbbá, a kovalens kötés lehet poláros vagy nem poláros.
Abban az esetben, egy nem-poláros kovalens kötés elektron felhő által alkotott közös elektronpárt elosztott térben képest szimmetrikusan a magok a két atom. A nem-poláros kovalens kötés képződik atomok közötti egyszerű anyagok, például, két ugyanazon gáz alkotó atomok kétatomos molekulák (O2. H2. N2, Cl2, stb).
Abban az esetben, a poláris kovalens kötés elektronikus kommunikációs felhő eltolódott az egyik atom. Képződése poláros kovalens kötések közötti atomok jellemző komplex anyagok. Ennek egyik példája a molekula illékony szervetlen vegyületek: HCI, H2 O, NH3 és mások.
A foka elmozdulása a teljes elektron felhő az egyik atom során kovalens kapcsolat (kötődés polaritás) határozza elsősorban a töltés, és a sugara atommagok kölcsönható atom.
Minél nagyobb a felelős az atommag, annál inkább vonzza az elektron felhő. Ugyanakkor, ha nagyobb a sugár az atom, annál kisebb a külső elektronok korlátozódnak közelében az atommag. A kombinált hatása E két tényező, és kifejeződik a változó képessége különböző atomok „késleltetés” self felhő kovalens kötés.
Az a képesség, az atom a molekulában, hogy vonzza az elektronokat nevezett elektronegativitása. Így, elektronegativitás jellemzi azt, hogy egy atom a polarizációs kovalens kötés: a több elektronegatív atommal, annál inkább tolódik a elektron felhő a kovalens kötés.
Ahhoz, hogy mennyiségileg elektronegativitási javasolt számos módszerrel. A leginkább egyértelmű fizikai jelentése az a módszer által javasolt amerikai kémikus Robert S. Mulliken, akik meghatározott elektronegativitási atom, mint a fele az összege a energiiEe elektronaffinitás és az ionizációs energiiEi:
A ionizációs energiája egy atom az az energia, kell fordított, hogy „letépni” belőle az elektron, és távolítsa el a végtelen távolságra. A ionizációs energia határozza meg fotoionizációs vagy elektron besugárzás atomok gyorsított elektromos térben. Ez a legkisebb érték a fotonok energiája, vagy elektronok, ami elegendő lesz ahhoz, hogy ionizálja az atomok és hívja őket ionizatsiiEi energiát. Jellemzően, ezt az energiát kifejezve elektronvolt (eV): 1 eV = 1,610 -19 J.
A legtöbb könnyen adja külső elektronok fématomok. amelyek tartalmazzák a külső héj kis számú páratlan elektronnal (1, 2 vagy 3). Ezek az atomok a legalacsonyabb ionizációs energia. Így, az ionizációs energia érték lehet egy intézkedés a kisebb vagy nagyobb „metallicitás” elemek: kevesebb, mint az ionizációs energia az erősebb kell lennie vyrazhenymetallicheskiesvoystva elem.
Az azonos alcsoportba a periódusos rendszer elemeinek D.I.Mendele-eva növekvő atomi száma az elem annak ionizációs energia csökken (2.1 táblázat), hogy a társított növekvő atomrádiusz (1.2 táblázat), és így a kommunikáció a gyengülő külső elektron a sejtmagba. A elemét azonos időszakban, az ionizációs energia növekedésével nő atomszámú. Ez annak köszönhető, hogy csökkent a atomrádiusz és a növekedés a nukleáris díjat.
Energia Ee. hogy áll a szabad elektron csatlakozási atom nazyvaetsyasrodstvom elektron (is expresszálódnak eV). Isolation (nem abszorpciós) energia csatlakozási töltésű elektron néhány semleges atomok azért van, mert a legstabilabb a természetben tele vannak atomok külső héj. Ezért, az atomok, amelyben ezek a kagyló „bit nincs tele” (azaz, nem elég ahhoz, hogy töltse ki a 1, 2 vagy 3 elektron), amíg az energetikailag kedvezővé hozzáragad az elektronok, egyre negatív töltésű ionok 1. Az ilyen atomok közé tartozik, például a , halogénatomok (2.1 táblázat) - a hetedik csoport elemek (fő csoport) a periódusos Mengyelejev rendszer. Az elektron affinitása a fématomok általában egyenlő a nulla vagy negatív, azaz a ez energetikailag kedvezőtlen csatlakozott további elektronok további energia szükséges, hogy azokat a jelent. Elektron affinitás nemfémes atomok mindig pozitív, és nagyobb, minél közelebb a nemes (semleges gáz) egy nemfémes a periódusos rendszerben. Mindez azt jelzi, usileniinemetallicheskih tulajdonságok ahogy közeledünk a vége az időszak.
A fentiekből nyilvánvaló, hogy a elektronegativitási (2.1) atomok irányába nő, balról jobbra az elemek minden egyes időszak és csökkenti a lefelé irányuló irányban az elemét azonos csoport a periódusos rendszer. Ez könnyű, azonban, hogy megértsék, hogy annak érdekében, hogy jellemezzük a fokát polaritását kovalens kötés az atomok közötti fontos, nem abszolút értéke elektronegativitású, és az arány a electronegativities az alkotó atomok a kötést. Ezért a gyakorlatban, használja a relatív elektronegativitási értékek (2.1 táblázat), figyelembe, mint egy egység elektronegativitása lítium.
Jellemzésére a polaritás kovalens kémiai kötés segítségével a relatív különbség electronegativities atomok. Jellemzően, a atomok közötti kötés az A és B minősül tisztán kovalens, ha | A -B | 0.5.