Hogyan állapítható meg, doxreakcióján
Abban az esetben, a kölcsönhatás a jellemző oxidáló és redukáló szerek, meg tudja mondani egy pillanat alatt, hogy ez egy redox reakciót. Például, a kölcsönhatás az alkálifémek savakkal vagy halogénekkel, oxigénnel égési folyamatok.
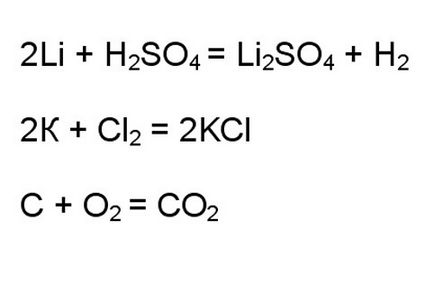
Tekintsük a bonyolultabb esetben a Például ha a reagáltatást kálium-permanganát, kálium-szulfit jelenlétében nagy mennyiségű lúg KOH. Annak érdekében, hogy a redox reakció mértékének meghatározására oxidációs elemek a jobb és a bal oldalon. Az atomok egyes elemeinek mindig fogadja el vagy adja ugyanazt az elektronok száma. Ez a reakció oxigén, hidrogén és a kálium. Más oxidációs állapotban különböző lehet, mint például a mangán és a kén.
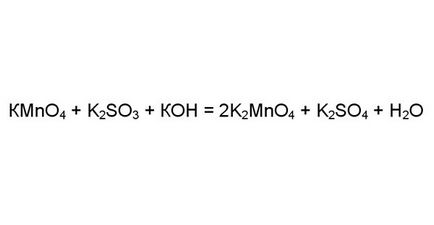
Határozzuk meg az oxidáció mértékét a mangán és a kén a bal oldalon az egyenlet. Vegyük kálium-permanganát: oxigén mindig az elektron akceptor oxidációs állapotú (-2). Négy 8 oxigén atommal elektronokat. Kálium - elektron donor és annak oxidációs állapotát (+1). Egy kálium-atom ad egy elektron. Ezután a mangán kell adni: 8-1 = 7 elektronokat.
Hasonlóképpen határoztuk meg, hogy a mértéke kén oxidációs kálium-szulfid (4). Három oxigénatomok vegye elektronok 6 és két kálium-atom donor két elektront.
Most keressük meg az oxidáció mértékét ezen elemek a jobb oldalon. A kálium-manganát K2MnO4 négy oxigénatom kapcsolódik nyolc elektronok és két kezelve két kálium-atom. Ennélfogva, mangán csökkent az oxidáció mértékét (7) a (6), azaz vissza.
Kén kálium-szulfát, fordítva, oxidáljuk (4) a (6). A molekula K2SO4 négy oxigénatom figyelembe nyolc elektron, de két adott két kálium-atom. Ezért, hat elektronok elvenni a kénatom.
Az oxidáció mértéke a mangán és a kén megváltozott. És akkor megállapíthatjuk, hogy a redox reakció.
Kémiai reakció - egy átalakítási folyamat az anyag eredő változást a készítményben. Azok az anyagok, amelyek reagáltatunk, nevezzük forrása, és azok, amelyek úgy vannak kialakítva ez a folyamat - termékek. Ez azért történik, hogy a kémiai reakció során elemek belépő az összetétele a kiindulási anyagok változtatni oxidációs állapotban. Azaz, akkor valaki másnak a elektronok és feladják. És valóban, míg a másik esetben, megváltoztatva a díjat. Az ilyen reakciókat nevezzük redox.

Jegyezze fel a pontos egyenlet kémiai reakció, hogy fontolgatja. Lásd, mely elemek szerepelnek a kiindulási anyagok, és milyen oxidációs foka ezen elemek. Ezután összehasonlítani ezeket a számokat a oxidációs fokú az azonos elemeket a jobb oldali részén a reakció.
Ha az oxidációs száma megváltozott, ez a reakció egy redox. Ha az oxidáció mértéke az elemek ugyanazok maradnak - nem.
Például, egy széles körben ismert reakció, kvalitatív kimutatására szulfátionok SO4 ^ 2-. Ennek lényege, hogy a szulfát-só bárium, amelynek képlete BaSO4, vízben gyakorlatilag oldhatatlan. A formáció a esik azonnal formájában sűrű sűrű fehér csapadékot. Rögzítse bármely egyenlethez hasonló reakciót, például, BaCl2 + Na2SO4 = BaSO4 + 2NaCl.
Tehát, a reakció azt látja, hogy amellett, hogy a csapadék a bárium-szulfát képződik a nátrium-klorid. Ez a reakció redox? Nincs, mert nincs elem jelenik meg a kiindulási anyagok nem változott annak oxidációs állapotát. És a bal és a jobb oldalon a kémiai egyenlet bárium oxidációs állapotban +2, -1 klór, nátrium +1, +6 kén-, oxigén- -2.
De a reakció Zn + 2 HCI = ZnCI2 + H2. Függetlenül attól, hogy a redox? Elemei a kiindulási anyagok: cink (Zn), hidrogén (H) és a klór (Cl). Lásd milyen oxidációs fok? Y cink, akkor 0, mint bármely egyszerű anyagnak hidrogén +1, y -1 klórt. Mik az oxidációs állapotai ezek az elemek a jobb oldalán a reakció? Klórvegyületek változatlan marad, vagyis egyenlő -1. De a cink lett egyenlő 2, és hidrogén - 0 (mivel a hidrogént izoláljuk, mint egy egyszerű anyag - gáz). Ezért ez a reakció egy redox.
Redox reakciók elengedhetetlenek az emberi szervezetben. Ezek nélkül lehetetlen az anyagcserét és a légzést folyamatokat. A legtöbb kémiai reakciók a természetben és az ipari termelés redox.

Mielőtt meghatározó redox reakciók, szükséges bemutatni néhány fogalom. Ezek közül az első - az oxidáció mértékét. Ez kondicionált töltés által birtokolt minden atom az anyag. Az összegzés oxidációját összes atom kell kap nulla. Így lehetséges, hogy megtalálja az oxidáció mértékét minden atom, amely különféle értékeket vehet fel.
Oxidáció - a folyamat visszarúgás elektronok atom és helyreállítási - hozzáadásával elektronok. Az oxidálószer lehet bármely olyan anyag, amely alkalmas arra, elektronok (helyreállított). A redukáló szer lehet bármely anyag, amely képes adományozni elektronokat (oxidálódnak).
Milyen reakciók redox?
Redox reakciók vezetnek változást oxidációs állapotú atomok anyagok jönnek reakció. Az oxidáció növekedését okozza az oxidáció mértékét és a helyreállítás - csökkenti. A szervetlen kémia, az ilyen folyamatokat lehet tekinteni, mint az elmozdulás egy elektront egy redukálószert az az oxidálószer.
Van többféle redox reakciók:
1. intermolekuláris reakciókhoz atomok, a változó az oxidáció mértéke, amelyek ugyanabból az anyagból. Ennek egyik példája a gyártási reakciót a kén-dioxid egy kén-dioxid.
2. Az intramolekuláris reakciók az atomok, amelyek megváltoztatják az oxidációs állapotban vannak a különböző anyagok. Például: a bomlási reakciója ammónium-dikromát.
3. önoxidációs vagy öngyógyítás. Az ilyen típusú reakciók redukálószer és az oxidálószer az egyik anyag.
Elektronikus egyenleg módszer
Szinte minden egyenletei redox nagyon nehéz megtalálni tényezők, hogy kiegyenlítse a bal és a jobb oldali rész. Erre találták ki az egyszerű és elegáns módszer az elektronikus mérleg. Ennek lényege abban rejlik, hogy a több elektront leadó mindig megegyezik a kapott összeg.
Tegyük fel, hogy a reakció előállítására alumínium-oxid. Először, meg kell pontosan azonosítani oxidáció mértékének anyagok atomok a bal és jobb oldalán az egyenlet. Az oxidáció mértéke az oxigén és alumínium megváltozott. Count az elektronok száma, amely adott alumínium. Meg kell egyeznie az elektronok száma került oxigént. két egyenlet kell tenni, és hozzák meg a kívánt arányt, ezért fordult a személyazonosságát. Ezeket az együtthatókat, és meg kell behelyettesíteni az eredeti egyenlet megfelelő atomok.