bemutatása 1 ammóniát
Előadás a „Ammónia 1. Összetétel szerkezete 3. Fizikai tulajdonságok 2. lépés ammónia laboratóriumi ipari 4. Kémiai tulajdonságok 5. 6. Application Test”. - átirata:
1 1. A készítmény ammónia. Szerkezet 3. Fizikai tulajdonságok 2. lépés ammónia laboratóriumi ipari 4. Kémiai tulajdonságok 5. 6. Application Test

2 1. A kémiai kötés az ammónia molekula: a) ion; B) poláris kovalens; B) nem-poláris kovalens. 2. Hogyan kapott ammónia a laboratóriumban: a) közvetlen szintézissel a nitrogén és hidrogén; B) termikus bomlása ammóniumsó; B) a kapott ammónium-sókat alkáliákkal. 3. Amint vehető ki ammónium-klorid és nátrium-klorid: a) szag; B) hatása révén ezüst-nitrát; B) hatása révén alkáli hevítésre. 4. A vizes ammónia-oldatot reagáltatjuk: a) sósavval; B) kalcium-hidroxid; B) vízzel. 5. Az ammónia képes oxidálni a szabad nitrogén: A) katalizátor nélkül; B) megnövelt nyomáson; B) katalizátorral. 6. A képződésének mechanizmusát egy ion (kation) ammónium-: A) donor-akceptor; B) ion; B) csoport; 7. reakcióvázlat szerinti reagáltatást NaOH + NH4CI = nátrium-klorid + NH 3 + H 2O megfelelő ionos rövid: A) NH H + = NH 4 + b) NH 4 + NH 3 = + H + A) NH OH = NH 3 + H 2 O B B B A A B

3 Összetétel. A szerkezet a NH 3 N 1s21s2 2s22s2 2p32p3 + H N H H3H H N 1s11s1 + δ + δ + δ + δ + δ + δ-δ-δ H vagy H H HN 107,3º poláros kovalens kémiai kötés kristályos molekulaszita rács

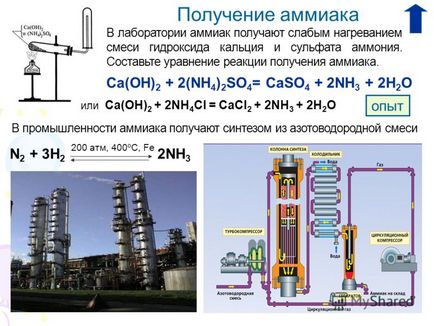
4. előállítás A laboratóriumban Ammónia gyenge állítjuk elő, hogy a kalcium-hidroxid és az ammónium-szulfát. Tedd reakció egyenlete ammónia. A Ca (OH) 2 + 2 (NH 4) 2SO 4 = CaSO 4 + 2NH 3 + 2H 2O ipari ammóniát ad a nitrogénoxid szintézisének keverékét 200 atm, 400 ° C, Fe N 2 + 3H 2 2NH 3 vagy Ca (OH) 2 + 2NH 4 Cl = CaCl2 + 2NH 3 + 2H 2O tapasztalat
6 Fizikai tulajdonságok Ammónia - színtelen gáz, szúrós jellegzetes szagú, könnyebb, mint a levegő. Határozzuk sűrűsége az ammónia a levegőben. Enyhe nyomással növekedése vagy hűtés közben - 33Sº ammónia folyékonnyá válik, egyre színtelen mobilis folyadék formájában. Ammónia oldható vízben: szobahőmérsékleten 1obeme 700 térfogatrész vízben oldható ammónia, 0 ° C-on - 1200 kötetek. D Sports. (NH 3) = M (levegő) / M (NH3) = 29 g / mol / 17 g / mol = 1,7raz

7 kémiai tulajdonságai NH 3 + H 2 O NH 3-H 2O-NH OH - 1) feloldjuk ammóniával vízben kíséri kémiai reakció vele: N H + H + + H HH HH HHN + donor-akceptor ammóniumkation 2) reakciót ammónia egy savval : NH 3 + HCl = NH 4CI Gyártmány egyenlet ammónia reakciók kénsavval (így szekunder és savas sók), salétromsav. NH 3 + H 2SO 4 = (NH 4) 2SO 4, NH 3 + H 2SO 4 = NH 4 HSO 4 A mechanizmus a kötés kialakulását - donor-akceptor NH 3 + HNO 3 = NH 4 NO 3 tapasztalat
8. A reakciót ammónia, hidrogén-kloriddal

9. A reakciót ammónia egy savval
Október 3) A oxidációja ammónia (katalizátor) 4NH 3 + 5O 2 = 4NO + 6H 2O A reakciókat, mint redox. Mik oxidáló szerekkel, redukáló szerek. N -3 - 5e N oxidációs O e 2O -2 május 4 Feloldás NH3 (miatt az N -3) - redukálószer; Mintegy 2 - oxidáló.

November 4) oxidációja ammónia (katalizátor nélkül) 4NH 3 + 3O 2 = 2N 2 + 6H 2O A reakciókat, mint redox. Mik oxidáló szerekkel, redukáló szerek. N -3 - 5e N oxidációs O e 2O -2 május 4 Feloldás NH3 (miatt az N -3) - redukálószer; Mintegy 2 - oxidáló. 5) Ammónia képes redukáló fém-oxidok inaktív NH 3 + N 2 CuO + Cu + H 2 O A reakciókat, mint redox. Mik oxidáló szerekkel, redukáló szerek. Rendezzük az együtthatók. 2N -3 - 6e N oxidációjának Cu e Cu hasznosítás NH 3 (miatt az N -3) - redukálószer; CuO (rovására Cu +2) - oxidáló. 2NH 3 + 3SuO = N 2 + 3Cu + 3H 2O tapasztalat
12 ammónia égetéséhez oxigént

Június 13.) Aktív fémek helyettesítheti hidrogénatom ammónia. Egy darab nátrium, folyékony ammóniában csökkentjük, hogy megfesti a lila szín eltűnik idővel, és miután az ammónia elpárologtatásával alján az üveg marad fehér por nátrium-amid: Tekintsük választ, mint redox. Mik oxidáló szerekkel, redukáló szerek. Rendezzük az együtthatók. NH 3 + Na NaNH2 + H 2 2H e H Na 0 - 1e Na NH3 (miatt H +1) - oxidáns helyreállítási folyamat; Na 0 - redukáiószer oxidációs folyamat. 2NH 3 + 2Na = 2NaNH 2 + H 2 nátriumamid
14 Laboratóriumi tapasztalat: Properties Ismételjük ammónium sók kvalitatív reakciója ammónium-ion. Helyezzük a fiolát reakcióelegyet ammónium-klorid és a kalcium-hidroxid, és melegítsük a keveréket. Határozzuk meg a kapott jellemző szaga ammónia és egy nedves indikátorpapírral.
1. Az ammónia használata 15 gyártása műanyagok és rostok 2. detergensek 4. A mezőgazdaságban, az orvostudomány 4. 6. előállítása robbanóanyagok 5. Salétromsav előállítása 3. Termelés a nitrogén műtrágyák
17 1. A vizes oldatot ammónia van: a) alkalikus közegben; B) savas környezetben; B) egy semleges környezetben; D) van egy helyes válasz közül a fenti. 2. A reakciót ammónia, hidrogén-kloriddal utal reakciók. A) bomlás; B) vegyületek; B) helyettesítés; D) cseréje. 3. Ammónia reakcióba lép a hevített réz-oxid (II), visszaállítva a fém réz. Amikor ez az ammónia oxidáljuk: a) szabad nitrogén; B) egy nitrogén-oxid (IV); B) egy nitrogén-oxid (II); D) nitrogén-oxid (V). 4. Ez nem egy redox reakciót ammónia: a) oxigén távollétében egy katalizátor jelenlétében; B) oxigén jelenlétében egy katalizátor jelenlétében; C) sósavat; D) oxid a réz (II). 5. Laboratóriumi Eljárás ammónia: a) szintézissel nitrogén és hidrogén; B) a kapott ammónium-klorid lúggal; B) termikus bomlása ammónium-klorid; D) Az összes fenti válasz helyes. 6. Írja az egyenlet a reakció az ammónia a kénsav moláris arányok 1: 1 és 2: 1. Összegek együtthatók ezek a reakciók A) 3 és 5; B) A 3. és 4.; B) A 4. és 5.; D) az 5. és 6. G A B B B