A sejt - studopediya
Galvánelem - kémiai áramforrás, ahol a felszabaduló energia során az áramlás a elektródák a redox reakció közvetlenül alakítjuk elektromos energiává.
A működési elve a cella lehet tekinteni a példája Daniel elem - Jacobi (9.2 ábra).
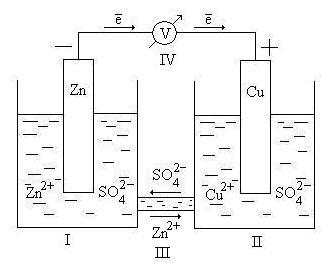
Ábra. 9.2. Scheme Daniel galvanikus elem - Jacobi
Itt - tartalmazó főzőpohárba ZnSO4 oldatot vízben bemerült ott cink lemez; II - tartalmazó főzőpohárba oldatot CuSO4 vízben vele belemerül a rézlemez; III - só-hidat (elektrolit kulcsot), amely mozgása kationok és anionok közül az oldatokat; IV - egy voltmérőt (szükséges mérésére elektromotoros erő, hanem egy része a sejt nem tartalmazza).
A standardpotenciál a cink elektród. A standardpotenciál a réz elektróda. Ettől. A cink-atom oxidált:
Az elektród, amelyen oxidációs reakció, hogy küldi vagy kationok egy elektrolit nevezzük az anód. Tekintettel az elektrokémiai cella szolgál az anód cink elektród. Mivel a standardpotenciál cink alacsonyabb, mint a réz, a cink elektród tulajdonítják, hogy a kondicionált díj „-”, és a réz - „+”.
Az elektronok által felszabadított a réz oxidációja megy végbe (az elektromos áram) a külső áramkörben.
A réz elektród a folyamat helyreállítása az elektrolit Cu 2+ kationok:
Az elektród, amelyen redukciós reakció kotoryyprinimaet vagy kationokkal az elektrolitból nazyvaetsyakatodom.
Miután az elektrolitikus kulcs egy mozgása az ionokra oldatban: SO4 2- anionok az anód, Zn 2+ kationok a katód. A mozgása az ionokra oldatban zárja az elektromos áramkört az elektrokémiai cella.
Reakciók (a) és (b) az úgynevezett elektróda reakciók.
Egyenleteket kombinálva lezajló folyamatok az elektródákon, a teljes egyenletet kapjuk redox reakció előforduló a cellában:
Zn + Cu 2+ = Zn 2+ + Cu