A nukleáris atom modell - vizsgálata, oldal 1
A nukleáris atom modell
Rutherford alapján a szórási kísérlet
alfa-részecskék egy földelt fémfólia atomok bolygókerekes modelljét atomi szerkezetét.
E modell szerint, az atom áll, egy nehéz pozitív töltésű mag nagyon kis méretek (
10-15 m), amely körül elektronok mentén mozognak néhány kering. A sugarak ezen pályák méretei
A jelenléte a felelős az elektron teszi a bolygó modell ellentmondó feltételek a klasszikus fizika, mivel forgó az elektron a mag körül, mint minden gyorsan mozgó töltött részecske kell elektromágneses hullámokat sugároznak. A spektrum ilyen sugárzás folyamatos legyen. Azokban a kísérletekben megfigyelt atomok lineáris spektrum sugárzás. Továbbá folyamatos sugárzás csökkenti az energia az elektron, és ez annak köszönhető, hogy a csökkentés a pályán kellett volna ebbe a sejtmagba.
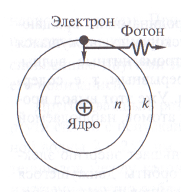
Niels Bohr posztulátumokat
Niels Bohr „mentett” bolygókerekes modell hidrogénatom, készítménnyé három posztulátumokat.
1. Egy elektron atom csak mozgatni egy bizonyos helyhez kering egy bizonyos számú n = 1; 2; 3; ... Mozgó fix zárt pályán az elektron konstans összenergia En.
2. megengedett stacioner kering csak azok, amelyek esetében a perdület az elektronok egyenlő egész számú többszörösével értéke Planck állandó
3. A foton emissziós vagy abszorpciós történik az átmenet atom egyik egyensúlyi állapotból a másikba. A sugárzási frekvencia
Kiszámítása a hidrogénatom Bohr
e - az elektron tömege
Megoldása a rendszer a két egyenletet, megkapjuk:
ahol a = 0,529. 10-10 m - sugara az első helyhez kötött
pályája a hidrogénatom
A mozgási energia az elektron
A potenciális energia az elektron
Az összes energia a p-edik pályára
A frekvencia a sugárzás az átmenetet a állapotban alkalmazni, hogy N
, ahol - a Rydberg állandó
Vannak még a Rydberg állandó ν és λ:
A hidrogénatomok (hélium ion He + Z = 2, dvuhkratno- ionizált lítium Li ++ c Z = 3, +++ trohkratnoionizovanny berilliumot Z = 4, stb) a sugarak az elektron kering a Z-szer kisebb, mint a egy hidrogénatom és egy hidrogénatom-ion spektrumot kapjuk szorzás Z2
A kvantum elmélet az atom
Bár Bohr jó eredményeket ad a hidrogénatomok, akkor nem tekinthető a teljes elmélet az atomi jelenségek.
Szemszögéből a modern fizika atom olyan fizikai rendszer, amely biztosan nem lehet által leírt klasszikus elmélet, hogy nem veszi figyelembe a hullám tulajdonságait mozgó elektronok a atomot, mint a de Broglie hullámhossza az elektron összemérhető atomi méretekhez.
A potenciális energia kölcsönhatás az elektron a nucleus a hidrogén-szerű atom
R- közötti távolság az elektron és a mag, amely első közelítésben,
Mi kell tekinteni, mint egy pont.
Mozgás egy elektron adott mezőben lehet tekinteni, mint mozgás gömb potenciális is.
A spektrum a elektron energia kell diszkrét, azaz Ez áll az egyedi energia szintek
értékek a teljes energia E 1 az elektron; E 2; E 3, stb
Schrödinger egyenlet
A megoldás Ennek az egyenletnek végezzük gömbi koordináták r, θ, φ. amelynek a középpontja egybeesik a központja a atommag. Egy ilyen rendszerben,
Egy négyzet operátor perdület egy gömbi koordináta-rendszerben
Schrödinger egyenlet alakítjuk
A megoldás az egyenlet keres egy terméket két funkció több változó
C figyelembe véve a természetes szemben támasztott Ψ- funkcióval egyértelműnek kell lennie, véges, folyamatos és zökkenőmentes.
A folyamat során a megoldására azt találtuk, hogy ezek a követelmények elégedett lehet minden pozitív érték az energia E, de a negatív értékek E - csak diszkrét értékeket, azaz ha
amely megfelel a kötött állapotba az elektronok egy atom.
Így Schrödinger egyenlet oldatot eredményeket abban az esetben, E 1 2 3 4 Az összes