kémiai hatása
27. § A kémiai hatása az elektromos áram
Sóinak oldatai és savak vízben vagy bármely más oldószer, áramvezetésre, és az úgynevezett elektrolitok, vagy vezetékek a második fajta, szemben a fémes vezetők, a vezetékek első fajta említett.
Az elektromos áram haladhat át táptalajt, melynek elektromosan töltött részecskéket képes mozogni.
Amikor az oldott sókat és savat vízben vagy bármely más oldószer (etil-alkohol, benzin, benzol, stb) a molekulák két részre tagolódik, az úgynevezett ionok. egyik része pozitív, a másik - egy negatív töltés.
Így, ellentétben a fémes vezetékek, ahol az elektromos hordozók elektronok, azok ionok elektrolitok.
Ionok lehetnek egyszerű vagy összetett. Egyszerű ion anyag képződik egyetlen atom. Ionok, amely egy néhány atom, úgynevezett komplex.
A szétesési kémiai vegyületek ionokra hatása alatt az oldatot nevezzük elektrolitos disszociáció és kifejezett szokásos kémiai egyenletek bal oldalán vannak elhelyezve a kémiai szimbólumok szétesést elősegítő szereket, és a megfelelő - ionok képződnek ezen anyagok. Például, a disszociációs egyenlet só (nátrium-klorid) felírható a következőképpen:
Ha egy edényben egy elektrolitot, hogy merítse a két fémlemez, ismert elektróda, amely vezetékes vezet csatlakoztatott a terminálok az egyenáramú áramforrás, mivel a potenciális különbség az elektródák között az elektroliton keresztül, hogy áram. Áramátmenettel az elektroliton keresztül kíséri kémiai folyamatok, viselő általános cím elektrolízis. Található elektrolit ionokat vonz a elektródák, mozgó ellentétes irányban, a pozitív ionok - a katód, míg a negatív - az anód. Közeledve a katód, pozitív ionok belőle előállított a hiányzó elektronok, és azok képezik elektromosan semleges atomok. Az anódon a fordított folyamat játszódik le: anód negatív ionok, így a felesleges elektronokat. Például a nátrium-klorid elektrolízisével oldatot viszünk a katód pozitív nátrium ionokat, és az anód - negatív kloridionmentesre (ábra. 24).
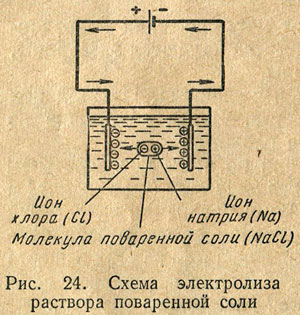
Ennek eredményeként, a folyamatos átmenetet az elektronok a katód ionokra, és a belépési, hogy az anód által támogatott mozgását elektronok a vezetékek csatlakoztatása az elektromos áramforrás az elektródákhoz.
Az átfolyó villamos áram segítségével az elektrolitot az elektródák vannak allokálva egy bizonyos mennyiségű anyagok egy kémiai vegyület az elektrolitban. A függőség a kiválasztott anyag a jelenlegi erőssége van beállítva első Faraday-törvény, amely az alábbiak szerint történik: anyag mennyisége felszabadult az elektródok által áramot vezetünk keresztül az elektrolitot közvetlenül arányos a villamos energia mennyisége áthaladt az elektrolit. A áthaladását villamos energiát az elektrolit medál kiosztott egy bizonyos súlyt anyag mennyisége, amely az úgynevezett elektrokémiai egyenértékű anyag.
A gyakorlatban számítások meghatározása mennyiségű villamos sokkal kényelmesebb használni nem medálok (k), és a amper-óra (Ah).
Elektrokémiai ekvivalenst grammban kifejezve, kapcsolódó 1 Ah elektromos mennyiség (t / a · h), m. E. Meghatározza súlya anyag mennyisége szabadul fel a elektrolit és a grammban kifejezve, miközben áthalad az elektrolitot az 1. és · h villamos mennyiség.
Jelölő I továbbra is erős az átfolyó áram az elektrolit során t h a elektrokémiai egyenértékű az anyag -. Through k. mennyiségének meghatározására tömeg anyag grammokban g felszabadult ez idő alatt:
Példa. Ha az aktuális áthaladó elektrolit mednokisly 1 és 1 órán át a katód szabadul 1,186 g réz, majd egy áram 10 A volt az azonos oldatot 10 órán kiemelt 1,186 × 10 × 10 = 118,6 g.
A legszélesebb körben alkalmazott az elektrolízis alkalmazása viszonylag vékony bevonatok bizonyos fémek, a másik (galvanizáló). Galvanizálás azért használjuk, hogy dekorációs cikkek megjelenése és korrózióvédelem. Ezen a módon előállítani arany bevonatot, ezüst, nikkelezés, és így tovább. D.
Elektrolízis is használják tisztítás (finomítás) a fémek, mint például a réz. Nyers réz lemez kapott kalcinálásával az ércet mártott anódként tartalmazó fürdőben réz-szulfát-oldattal savanyítjuk kénsavval, hogy vezetőképességének javítására az elektrolit. Katódok Ezek a fürdő vékony vörösréz lemez, amelyen letétbe elektrolitikus réz, és a lerakódott szennyező anyagokat az a kád alján.
A nagyon gyakori Eljárás elektrolit maró lúgok nátrium, kálium és a klór, valamint az oxigén és hidrogén.